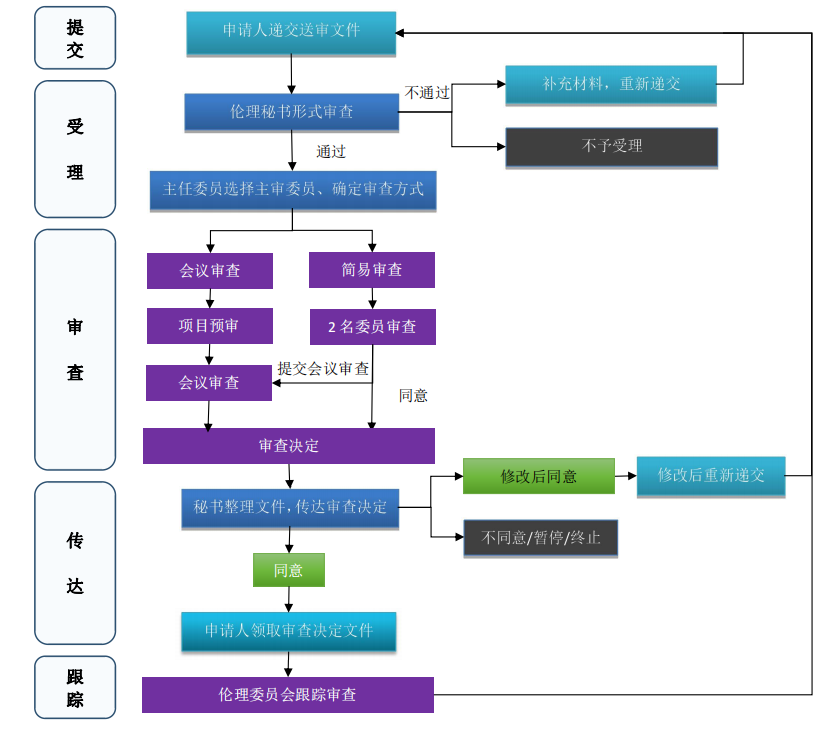
(一)提交伦理审查的流程
1.送审
(1)送审责任者:研究项目的送审责任者一般为PI/申办者/CRO。
(2)准备送审文件:根据《送审文件清单》,准备送审文件。
(3)填写申请/报告的表格:根据伦理审查申请/报告的类别,填写相应的“申请”表格。
(4)提交:
① 初始审查申请应先提交1份已签字、盖章的纸质送审文件(超过两页以上的文档双面打印),同时将电子版送审文件(PDF格式)发送至伦理委员会邮箱。送审文件通过形式审查后,须另外准备书面送审文件(复印件)12份,送至伦理委员会办公室。
② 跟踪审查申请须提交2份已签字、盖章的纸质送审文件送至伦理委员会办公室。如审查形式为会议审查,须另外准备11份书面送审文件(复印件),送至伦理委员会办公室。
2.领取通知
(1)补充/修改送审材料通知:由秘书进行形式审查,发现送审文件不完整,文件要素有缺陷,发送《补充/修改送审材料通知》,告知缺项文件、缺陷的要素,以及最近审查会议日期。
(2)受理通知:送审文件的完整性和要素通过形式审查后,由秘书发送《受理通知》,并告知预定审查日期。
3.接受审查的准备
会议通知及准备:秘书通过电话/短信/邮件等方式通知申请人伦理审查会议时间及地点;PI参照《研究者汇报项目提纲》(F-LL-03-GZZN-1-9-X)准备汇报PPT,提前递交伦理委员会办公室,并到会汇报。伦理办公室会事先与PI协商会议时间,以确保PI能到会报告,如后续PI因故不能到会报告,应事先向伦理委员会办公室请假并告知申办者,该项目将转入下次会议审查。
(二)伦理审查的时间
每月10日(含)之前提交的伦理申请会在本月进行审查。超过上述时间提交的材料会在下月伦理会议中审查。按照递交材料先后顺序安排伦理审查会议。如遇特殊情况,会接收当月10日之后至会前5个工作日的紧急申请。
研究过程中出现紧急事件(如果处理延误将直接或间接影响公众利益、造成国家经济损失等紧急情况);与试验用药品/医疗器械相关的SAE/SUSAR导致死亡或危及生命;或发生其它需要伦理委员会召开会议进行紧急审查和决定的情况,伦理委员会将及时召开紧急会议进行审查。
(三)审查决定的传达
伦理委员会办公室在做出伦理审查决定后10个工作日内,以“伦理审查批件”或“伦理审查意见”的书面方式传达审查决定。如果审查类别属于安全性信息审查,不依从/违背方案审查,暂停/终止研究审查,结题审查,以及上述审查类别审查后的再审,并且审查意见为“同意”(同意继续研究,或不需要采取进一步的措施),伦理委员会的决定不以书面形式传达。
(四)免除知情同意
根据国家卫健委医学伦理专家委员会办公室、中国医院协会发布的《涉及人的临床研究伦理审查委员会建设指南》的要求:在满足下列必要充分条件时,伦理审查委员会可以同意豁免知情同意:
1.受试者可能遭受的风险不超过最低限度。
2.豁免征得受试者的知情同意并不会对受试者的权益产生负面影响。
3.利用可识别身份信息的人体材料或者数据进行研究,已无法找到受试者,且研究项目不涉及个人隐私和商业利益。
4.生物样本捐献者已经签署了知情同意书,同意所捐献样本及相关信息可用于所有医学研究。
需注意:豁免征得知情同意,不意味着免除伦理审查委员会的审查。如需申请豁免知情同意,请同时填写并递交《免除知情同意申请》(F-LL-03-GZZN-1-10-X)。
(五)免除知情同意签字
以下两种情况可以申请免除知情同意签字:
1.研究对受试者的风险不大于最小风险,并且如果脱离“研究”背景,相同情况下的行为或程序不要求签署书面知情同意。例如,访谈研究,邮件/电话调查。
2.当一份签了字的知情同意文件会对受试者的隐私构成不正当的威胁,研究中确定受试者真实身份的唯一记录是知情同意文件,并且主要风险就来自于受试者身份或个人隐私的泄露。在这种情况下,应该遵循每一位受试者本人的意愿是否签署书面知情同意文件。
对于同意免除签署书面知情同意文件的研究项目,伦理委员会可以要求研究者向受试者提供书面告知信息。如需申请豁免知情同意签字,请同时填写并递交《免除知情同意签字申请》(F-LL-03-GZZN-1-11-X)。
(六)伦理审查的费用
申办方向伦理委员会递交药物临床试验、医疗器械临床试验和体外诊断试剂临床试验项目的初始申请时,需要交纳伦理审查费,具体收费标准如下:
会议审查,初始审查费用:5000元/项。(若同一个试剂类项目的试剂盒超过5个,每超过1个加收1000元)
简易审查,初始审查费用:2500元/项。如简易审查转为会议审查,需在伦理审查决定书送达后补交2500元/项。
修正案审查:2000元/项。
如遇特殊情况,申办方提出加急审查申请,需要按规定另行收取加急审查费用,加急后审查费用为普通审查费用的1.5倍。
伦理审查费应在伦理委员会召开会议前缴纳,转账后,向伦理办公室提交电子版银行转账凭证,同时提供开票信息。伦理办公室收到转账凭证后将通知财务科核实试验费用到账情况,根据汇款单位及汇款明细开具正式财务发票。发票开出后,伦理办公室至财务科领取发票,并通知申办者/CRO凭银行转账凭证至伦理委员会办公室领取发票。